Темы
Этиология аутоимунного мужского бесплодия
12 Октября 2016Одной из причин мужского бесплодия являются аутоиммунные реакции против сперматозоидов, которые сопровождаются выработкой антиспермальных антител – АСАТ [1, 2, 3, 4]. Антитела вырабатываются ко многим антигенам сперматозоидов, в основном к тем, которые начинают экспрессироваться после мейоза и в придатке [5]; некоторые из них рассматривают в качестве кандидатов для разработки контрацептивной вакцины [6]. В то же время этиология развития антиспермального иммунитета не ясна. Исследователи отмечали взаимосвязь между наличием АСАТ и непроходимостью семявыносящих путей, инфекциями репродуктивного тракта, орхитом, простатитом, варикоцеле, крипторхизмом, перекрутом яичка [2–4, 7, 8, 9]. Однако абсолютный и относительный риск развития бесплодия при действии различных повреждающих факторов остаются неизвестными. Более того, некоторые исследователи отрицают взаимосвязь АСАТ с варикоцеле [10, 11], хроническим воспалением и инфекциями [12, 13], крипторхизмом [14] и другими перечисленными факторами риска снижения мужской репродуктивной функции. По мнению M.Marconi и W.Weidner – авторов соответствующего раздела в монографии «Immune infertility» [15], только хроническая обструкция мужского репродуктивного тракта является доказанным фактором риска появления АСАТ; другие – тестикулярная травма, перекрут и хирургические вмешательства на яичках, – требуют дополнительных доказательств; для инфекционно-воспалительных процессов, варикоцеле, крипторхизма, тестикулярных опухолей и гомосексуализма подтверждения пока нет.
Цель исследования
Уточнить роль различных факторов (за исключением обструкции) в этиопатогенезе аутоиммунных реакций против сперматозоидов.
Материалы и методы
Выполнено клинико-лабораторное обследование 536 мужчин из бесплодных пар (18–45 лет); контрольную группу составили фертильные мужчины, жены которых были беременны на сроке 8–16 нед (n=82).
Исследование спермы проводили в соответствии с требованиями ВОЗ [16]. Определение АСАТ IgG и IgA на сперматозоидах осуществляли методом MAR (Ferti Pro N.V., Бельгия) и с помощью проточной цитофлуориметрии (ПЦМ) на аппаратах Facscan (Becton Dickinson, США) и Bryte (Bio- Rad, Италия). Оценку окислительного стресса (ОС) осуществляли путем определения интенсивности свободнорадикальных процессов методом люминолзависимой хемилюминесценции, с использованием люминометра «LKB-Wallac 1256» (Финляндия) и «Хемилюминометра-003» (Россия). Повреждение ДНК сперматозоидов характеризовали по дисперсии хроматина в агарозном геле с визуальной оценкой под микроскопом [17]. Количество и соотношение иммунокомпетентных клеток в периферической крови определяли методом ПЦМ, содержание интерферонов (ИФН) в крови, естественную и индуцированную in vitro продукцию ИФН – по методу Кемпбелла. Диагностику инфекций репродуктивного тракта (ИРТ) осуществляли по наличию специфической ДНК методом ПЦР с использованием наборов НПФ «Литех», для условно-патогенных микроорганизмов – посевом на питательные среды.
Статистическая обработка данных выполнена с применением пакета прикладных программ «Statistica» (StatSoft, США). Проводили анализ частных корреляций посредством сравнения результатов построения общих линейных моделей с учетом ковариат. Для оценки эффектов межгрупповых факторов применяли дисперсионный анализ и метод логистической регрессии, анализ модели на каждом шаге оценивался по показателям хи-квадрат, R-квадрат Кокса и Снелла. Использовали различные модели импутации данных, значимость модели характеризовали по критерию Вальда.
Полученные результаты
На первом этапе анализировали потенциальные факторы риска иммунного бесплодия по отдельности.
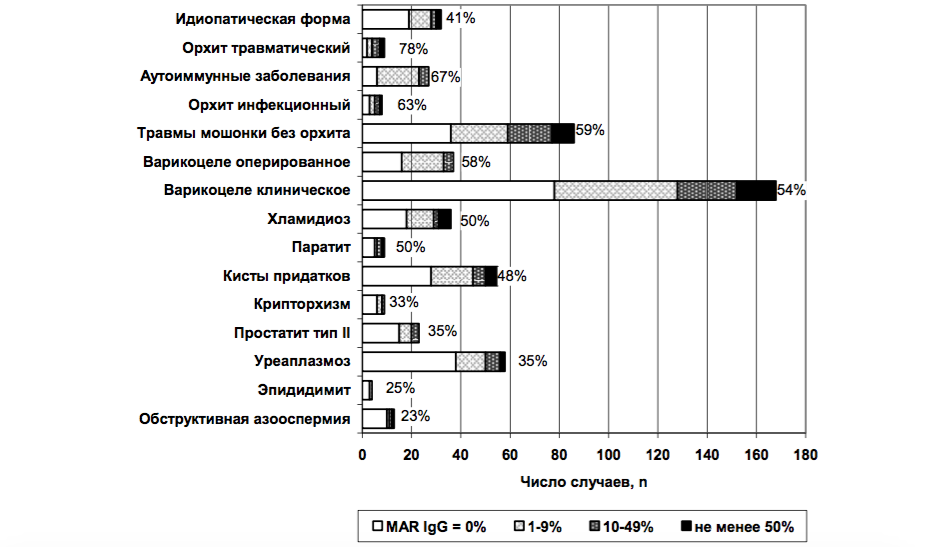
Рис.1. Аутоиммунные реакций против сперматозоидов при различных факторах риска развития мужского бесплодия, n и %.
Примечание: выделенные группы отличаются наличием только одного указанного фактора риска; пациенты, имеющие сочетание нескольких факторов риска в анализ не включены.
Травмы мошонки
Корреляционный анализ показал, что имеется прямая зависимость между результатами MAR IgG-теста с одной стороны, и травмами мошонки в анамнезе (Gamma=0,47; p=0,00003). Анализ по средним значениям, показал, что для пациентов с травмами мошонки ха- рактерны более высокие значения MAR IgG: в отсутствие травм медиана – 0% (среднее 21%); при наличии травмы – 15% (45%), соответственно (p=0,002). Абсолютный риск обнаружения АСАТ после субклинических травм – 59%, после травматического орхита – 78% (рис.1). У пациентов с иммунным бесплодием по ВОЗ (MAR IgG>50%) субклиничесике травмы мошонки имели место в 35% случаев, у пациентов без АСАТ – в 19% (рис.2), т.о. относительный риск (отношение шансов - ОШ) развития иммунного бесплодия после субклинических травм больше в 1,84 раза (p<0,001).
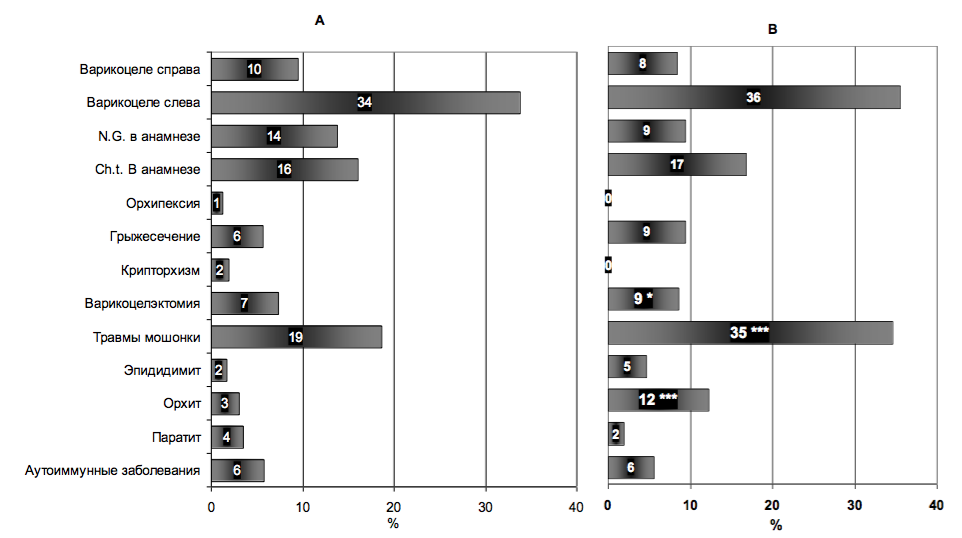
Рис.2. Частота обнаружения различных факторов риска снижения качества спермы у мужчин из бесплодных пар без АСАТ (А) и с иммунным бесплодием по ВОЗ (В).
Примечание: * - различия статистически достоверны с p<0,05; *** - с p<0,001.
Орхит
Корреляция между перенесенным орхитом и АСАТ высоко значима (Gamma=0,28; p=0,00009). У пациентов после перенесенного орхита существенно больше средние значения MAR IgG: медиана 8% (среднее 26%) и 0% (16%) соответственно (p=0,00003). Абсолютный риск появления АСАТ после инфекционного орхита – 63%, травматического – 78% (рис.1). У пациентов с иммунным бесплодием орхит имел место в 12% случаев, без АСАТ – в 3% случаев (рис.2), следовательно, ОШ развития иммунного бесплодия после орхита – 4,0 (p<0,001).
Варикоцеле
Существует взаимосвязь между количеством АСАТ и выполненной ранее варикоцелэктомией: для MAR IgG Gamma=0,42 (p=0,0006), для ПЦМ IgG Gamma=0,35 (p=0,012). Риск иммунного бесплодия после варикоцелэктомии увеличивается незначительно, но статистически значимо (ОШ=1,1; p<0,05). Корреляция между степенью варикоцеле и наличием АСАТ зависит от использованного метода и класса АСАТ: несущественна для MAR IgG и IgA (p>0,05), но достоверна при определении IgA на всех живых гаметах методом ПЦМ (Gamma=0,23; p=0,001). Причем эта взаимосвязь статистически значима только в группе мужчин с первичными нарушениями фертильности (Gamma=0,31; p=0,0005); при вторичном бесплодии такая закономерность отсутствует (p>0,05). При дисперсионном анализе некоторые из ковариат оказывают значимое влияние на взаимосвязь факторов «степень варикоцеле слева» и «MAR IgG»: перенесенная травма мошонки (F=9,54; p=0,02) и ранее перенесенный орхит (F=3,39; p=0,036). В присутствии урогенитальных хламидий и микоплазмы уровень значимости такой связи также возрастает (р=0,005 и 0,019 соответственно против 0,057 и 0,266 без учета ковариат).
От наличия варикоцеле зависит риск появления АСАТ после орхита. В группе мужчин, у которых в результате травмы мошонки развился орхит, в 87% случаев имелось сопутствующее варикоцеле (при 11% в группе с атравматическим и 35% с субклиническим орхитом, р<0,001 и 0,05 соответственно). Если травма мошонки имела место у мужчин с варикоцеле, иммунное бесплодие развивается в 1,4 раза, а орхит – в 4,1 раза чаще, чем при травме мошонки в отсутствии варикоцеле (р<0,05).
После варикоцелэктомии у пациентов с иммунным бесплодием (n=28) через 3 мес общее количество прогрессивно-подвижных сперматозоидов в эякуляте увеличилось в 1,71 раза (р=0,021), но доля морфологически нормальных форм не выросла (р>0,05), снижения процента АСАТ–позитивных сперматозоидов не произошло (p>0,05). Улучшение имело место у половины пациентов, при этом прогностически благоприятным признаком является большая степень расширения вен семенного канатика (1,8+0,4 и 1,3+0,5, соответственно; p<0,05) и более низкий процент АСАТ–позитивных сперматозоидов (41,1+25,1 и 74,8+30,8; p<0,01).
Инфекционно-воспалительные процессы
АСАТ на фоне хламидийной инфекции обнаружены в 29% случаев. Существует значимая взаимосвязь между присутствием Chlamydia trachomatis в репродуктивном тракте и АСАТ класса IgG (для MAR Gamma=0,21; p=0,0007; для ПЦМ Gamma=0,28; p=0,017). Однако корреляция перестает быть статистически достоверной при исключении пациентов с орхитом, тестикулярной травмой и/или варикоцелэктомией в анамнезе, что позволяет считать хламидийную инфекцию ко-фактором, приводящем к появлению АСАТ только при наличии дополнительных повреждающих факторов и/или некой предрасположенности. К такой предрасположенности можно отнести повышенную реактивность иммунной системы в ответ на инфекцию: в отсутствии C.trachomatis количество АСАТ от продукции ИФН не зависит, при хламидиозе – существует достоверная положительная корреляция (рис.3).
Роль хламидийной инфекции подтверждена результатами лечения (n=35) – уже через месяц в большинстве случаев (p<0,05) происходит снижение доли АСАТ-позитивных сперматозоидов. В среднем уменьшение составляет 22% в относительных значениях (p<0,01), у некоторых АСАТ исчезли полностью (максимальное снижение MAR IgG - 60%), причем, чем выше исходно активность аутоиммунного процесса, чем хуже результаты лечения (таб.1).
Наличие уреаплазм не связано с АСАТ: отсутствует значимая корреляция (p>0,05; n=618), излечение уреаплазменной инфекции не приводит к снижению количества АСАТ-позитивных сперматозоидов (p>0,05; n=56).
Лечение хронического бактериального простатита у пациентов с аутоиммунными реакциями против сперматозоидов так же не приводит к значимому снижению количества АСАТ (p>0,05; n=29); при этом после лечения сохраняются повышенные уровни активных форм кислорода (АФК).
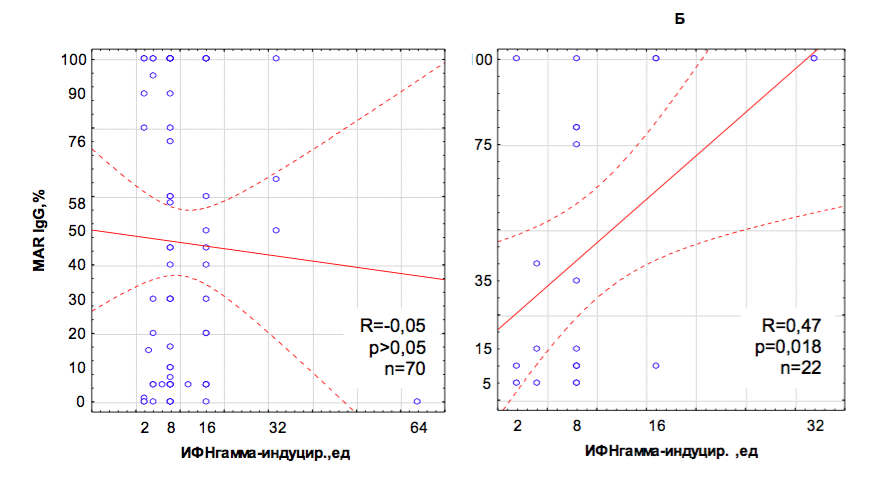
Рис.3. Зависимость между MAR-IgG и продукцией лейкоцитами ИФН у мужчин без инфекционно-воспалительного процесса (А) и при урогенитальном хламидиозе (Б).
Примечание: концентрация сперматозоидов не менее 10 млн/мл; прогрессивно-подвижных больше 10%; различия между коэффициентами корреляции А и Б значимы с p<0,05.
Спермограмма пациентов с урогенитальным хламидиозом и АСАТ через месяц после антибиотикотерапии, n и M+S
| Параметры | Исходно | После лечения | Улучшение /всего |
|---|---|---|---|
| Концентрация (млн/мл) | 66.8+54.4 | 72.6+71.1 | 19/35 |
| Подвижность А (%) | 12.7+11.9 | 19.3+18.0* | 18/35 |
| Подвижность В (%) | 17.0+16.1 | 15.1+9.5 | 16/35 |
| Патологич. форм (%) | 30.7+19.2 | 26.5+12.1 | 23/35 |
| Лейкоциты (млн/мл) | 0.86+0.95 | 0.47+0.46** | 15/35 |
| Сперматозоидов с нормальной морфологией и подвижностью (млн/эяк) | 58.9+93.8 | 72.2+88.1 | 31/35## |
| MAR IgG (%) | 52.6+48.4 | 41.2+55.5** | 24/35# |
Примечание: пациенты с орхитом, травмами мошонки, варикоцелэктомией в анамнезе исключены из анализа; MAR%IgG>10, концентрация сперматозоидов не менее 10 млн/мл; * - различия по критерию Стьюдента достоверны с p<0,05; ** - с p<0,01; # - по критерию знаков с p<0,05; ## - с p<0,01.
Крипторхизм и орхипексия, паратит, эпидидимит, грыжесечение
Крипторхизм и орхипексия, паратит, эпидидимит, грыжесечение и другие потенциальные факторы риска снижения фертильности мужчин не оказали значимого влияния на ОШ развития иммунного бесплодия (рис.2). Различия между всеми группами риска по распространенности АСАТ статистически не достоверны (p>0,05). Более того, распространенность АСАТ в группе мужчин, у которых перечисленные факторы риска снижения фертильности отсутствуют, так же высока – 41% (рис.1).
В совокупности предикторы «орхит», «травмы мошонки», «варикоцелэктомия», «степень варикоцеле слева», «урогенитальные хламидии», «содержание В-лимфоцитов в крови, % и млн/мл», «интерферон сыворотки крови» формируют 45% дисперсии зависимой переменной «MAR IgG» и верно предсказывают значения зависимой переменной для 79,5% наблюдений. Однако статистики критерия Вальда, проверяющие значимость модели неудовлетворительны, содержание значений использованных переменных несбалансировано, само уравнение логита демонстрирует противоречия возможным теоретическим основаниям. Было сформировано пять моделей импутации данных, однако по всем пяти моделям уравнения логистической регрессии характеризовались очень низкой адекватностью и предсказательной способностью. Это, очевидно, означает, что ни один из учитываемых клинико-анамнестических факторов, кроме травм мошонки не является непосредственной причиной развития аутоиммунных реакций против сперматозоидов и появления АСАТ.
Оксидативный стресс
Независимо от причины возникновения аутоиммунных реакций против сперматозоидов у мужчин с АСАТ в большинстве случаев повышена продукция в сперме АФК: между этими характеристиками эякулята существует положительная корреляция (рис.4А); одновременно у мужчин с АСАТ пропорционально продукции АФК увеличен процент сперматозоидов с фрагментацией ДНК (рис.4Б).
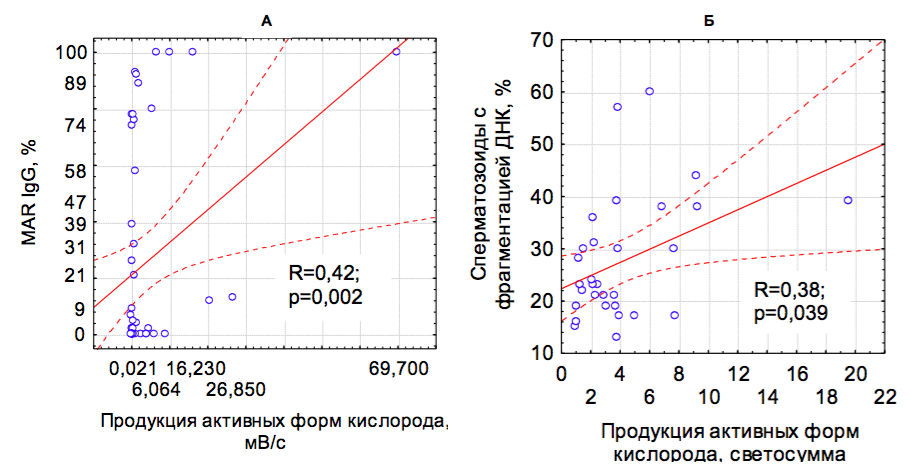
Рис.4. Взаимосвязь между процентом подвижных АСАТ-позитивных сперматозоидов (MAR IgG) и продукцией АФК (А), продукцией АФК и фрагментацией ДНК сперматозоидов.
Обсуждение
Имеющиеся данные позволяют предположить несколько механизмов развития аутоиммунных реакций против сперматозоидов, не связанных с обструкцией.
Нарушение целостности гемато-тестикулярного барьера (ГТБ)
Нарушение целостности гемато-тестикулярного барьера (ГТБ) при травме органов мошонки и орхите, что подтверждается многочисленными клиническими и экспериментальными исследованиями [4, 7, 15 и др.]. Мы не согласны с мнением R.Lee и соавторов, что «the old dogma that any breach of the blood–testis barrier would induce the production of ASA is no longer valid» [18]. Факт, что резекция яичка и биопсия обычно не ведет к выработке АСАТ [19, 20] объясняется тем, что способность к сохранению сперматогенеза зависит, с одной стороны, от сохранения относительно нормальной трофики органа после резекции (в отличии от травмы, приводящей к образованию гематом и ишемии ткани), с другой – от объема сохраненной паренхимы. В настоящее время принято считать, что толерантность к сперматозоидам зависит не столько от пассивной иммуносупрессии - спермальные антигены не попадают в кровоток и низкоиммуногенны из-за отсутствия антигенов HLA, - сколько от активной - индукции апоптоза аутореактивных лимфоцитов с помощью Fas, иммуносупресивных эффектов TGF-beta и IL-10 и некоторых других механизмов [21].
Микроорганизмы как антигены и перекрестные иммунные реакции
Имеются данные, что АСАТ способны перекрестно реагировать с бактериальными антителами, что свидетельствует о молекулярном сходстве между антигенами сперматозоидов и патогенных микроорганизмов (S.aureus, E.coli, P.aeruginosa и P.mirabilis) [8, 22]. На возможности перекрестных реакций указывает ассоциация иммунного бесплодия с определенными гаплотипами HLA [2]. По нашим данным одна из причин образования АСАТ - C.trachomatis. Поскольку в большинстве случаев инфицированные C.trachomatis пациенты имеют относительно нормальные показатели спермограммы и низкие уровни АСАТ класса IgA, есть основания считать, что антиспермальный иммунитет в этом случае связан не с нарушением сперматогенеза, а со способностью микроорганизма прикрепляться к поверхности сперматозоида. Эти «частички» в дальнейшем могут служить как антигены или гаптены, запуская аутоиммунные реакции [8]. Местом первичной иммунизации и продукции АСАТ в этом случае, очевидно, являются эпидидимис и простата [15]. В то же время наши данные подтверждают точку зрения тех исследователей, которые считают, что большинство микроорганизмов, существующих в репродуктивном тракте мужчин (уреаплазмы, микробная флора при хроническом простатите) обычно не вызывают появление АСАТ [12, 13]. Вероятно, для развития антиспермального иммунитета при инфекциях репродуктивного тракта важны особенности, как микроорганизма, так и пациента: хламидии индуцируют появление АСАТ у части мужчин, а элиминация возбудителя не всегда приводит к исчезновению АСАТ. Очевидно, условием развития аутоиммунных реакций является исходно избыточный ответ иммунной системы на присутствие инфекционного агента.
Активация иммунитета и оксидативный стресс
Нами ранее описано увеличение количества лейкоцитов в сперме, НК- клеток и В-лимфоцитов в крови, содержания в крови ИФН у пациентов с АСАТ [4]. Согласно традиционным представлениям развитие аутоиммунных реакций против сперматозоидов выглядит следующим образом [23]: первоначально происходит связывание фиксированных специфических к сперматозоидам иммуноглобулиновых рецепторов, расположенных на поверхности В-лимфоцитов, с антигенами сперматозоидов и облегчение их прикрепления и презентации Т-лимфоцитам. Следствием этого является экспансия специфичных к спермальным антигенам Т-лимфоцитов и высвобождение цитокинов, которые стимулируют дифференцировку специфичных к спермальным антигенам В-лимфоцитов и увеличение продукции АСАТ. Активированные Т-клетки также продуцируют ИФН, который стимулирует экспрессию молекул HLA-комплекса на поверхности макрофагов (усиления экспрессии HLA-антигенов на АСАТ-позитивных сперматозоидах нет [24]). Фагоцитоз сперматозоидов макрофагами в репродуктивном тракте и, соответственно, презентация спермальных антигенов в комплексе с HLA классов I и II Т-клеткам приводит к дальнейшей активации и увеличению количества спермспецифических Т-клеток в генитальном тракте. Однако конкретные антигены сперматозоидов, которые стимулируют иммунную систему, и механизмы первоначальных реакций, приводящих к нарушению фертильности, не установлены [2, 3, 5, 6]. В настоящем исследовании мы уточнили роль инфекций репродуктивного тракта: в присутствии C.trachomatis имеется прямая корреляция между индуцированными ФГА уровнями ИФН и процентом АСАТ-позитивных сперматозоидов (хотя принято считать, что ИФН является антагонистом развития гуморального иммунитета [211]). Кроме влияния на Т-, В- и НК-клетки, стимулирующее действие ИФН является причиной гиперпродукции АФК макрофагами, участвующими в килинге внутриклеточных микроорганизмов [25].
По нашему мнению, ОС - следствие гиперпродукции АФК, - является ключевым моментом развития иммунного мужского бесплодия. Известно, что ОС способен приводить к повреждению мембраны сперматозоидов, снижению их подвижности и нарушению оплодотворяющей способности [26, 27]. По нашим данным у мужчин с иммунным бесплодием даже в отсутствие инфекционного процесса продукция АФК повышена более чем в 3 раза; между АФК и АСАТ имеется прямая зависимость, причем продукция АФК больше зависит от количества антител на сперматозоидах (по данным ПЦМ), чем от процента подвижных АСАТ-позитивных гамет (MAR) [28]. ОС сперматозоидов, с одной стороны, может вызывать изменения структуры липидов, белков, нуклеиновых кислот, делая их иммуногенными, с другой - препятствовать сбрасыванию АСАТ с поверхности клетки. С повышением ригидности цитолеммы связана пониженная способность сперматозоидов сбрасывать аутоантигены, а так же освобождаться от налипших «частичек» - микроорганизмов и антител; ранее нами описана способность сперматозоидов формировать «петчи» комплексов антиген-антитело в пределах своего домена и «шадинг» - сбрасывание этих комплексов с поверхности клетки [29].
Можно предположить, что аутоиммунный процесс инициируют не какие-то «особые» аутоантигены, поиск которых безуспешно идет несколько десятилетий [6], а любые антигены сперматозоидов, при условии:
- если отличаются от продуктов органоспецифических генов, экспрессированных в медуллярных эпителиальных клетках тимуса, и презентированным Т-клеткам при их развитии в тимусе, т.е. ставшие дефектными в период онтогенеза на стадиях после деления сперматогоний типа А;
- если спермальные антигены отсутствуют в необходимом количестве в семенной плазме в растворенном виде.
Принято считать [211], что толерантность к аутоантигенам поддерживается всю жизнь за счет отрицательной селекции Т-клеток в тимусе, кнормальным антигенам сперматозоидов клеточного иммунного ответа быть не должно. Причем не только в самом яичке, где барьерную функцию выполняют плотные контакты между сустентоцитами (клетками Сертоли) и происходит подавление всех активированных цитотоксических лимфоцитов Fas-лигандом, но и за его пределами. Поскольку V-гены В- лимфоцитов подвержены соматическим мутациям, возможно изменение их специфичности, выработка аутоантител и, следовательно, помимо центральной, необходима периферическая толерантность. Аутореактивные В- клетки, образованные при соматической мутации, подвергаются делеции, если реагируют на растворимый антиген и не получают помощи от Т- клеток, что происходит за счет Fas-независимого апоптоза. Следовательно, наличие растворенных (свободных) антигенов сперматозоидов является условием поддержания толерантности против собственных гамет, наряду с целостностью гемато-тестикулярного барьера, отсутствием аутореактивных Т-клеток и экспрессии молекул HLA на клетках, несущих аутоантиген. Повышение ригидности мембраны сперматозоидов и снижение продукции растворимых спермальных антигенов на фоне ОС может являться фактором, снижающим неотвечаемость В-клеток к клеточным антигенам гамет. АСАТ при этом вырабатываются к антигенным структурам наиболее активно продуцирующих АФК герминативных клеток – незрелым и патологически измененным. В широком смысле слова, АСАТ являются следствием генетически обусловленного и/или приобретенного повреждения клеток. Установить эту причину удается не всегда, поэтому более чем в 40% случаев иммунное бесплодие кажется идиопатическим. В этом контексте, АСАТ могут рассматриваться как один из механизмов элиминации неполноценных мужских половых клеток и маркером плохого качества спермы.
Роль ОС в патогенезе мужского иммунного бесплодия подтверждает использование антиоксидантов, способных химически связать избыток АФК и восстановить свойства цитолеммы – на фоне лечения происходит быстрое уменьшение доли АСАТ-позитивных сперматозоидов и нормализация акросомной реакции сперматозоидов [30].
Обнаруженная нами взаимосвязь между АСАТ, ОС и фрагментацией ДНК снова поднимает вопрос о месте вспомогательных репродуктивных технологий в лечении мужского иммунного бесплодия – постулированное в недавнем мета-анализе [31] положение, что АСАТ не снижают процент наступивших беременностей после ЭКО и ИКСИ не означает отсутствие влияния на исходы беременности и здоровье детей.
Заключение
Высокий риск развития аутоиммунных реакций против сперматозоидов связан с повреждением ГТБ в результате травм мошонки. Варикоцеле является ко-фактором, который повышает риск иммунного бесплодия при различных повреждающих воздействиях; варикоцелэктомия способствует снижению АСАТ при большей степени варикоцеле и менее выраженном аутоиммунном процессе. Инфекционно-воспалительные процессы репродуктивного тракта приводят к появлению АСАТ в результате перекрестных реакций (C.trachomatis) и/или иммуноопосредованных механизмов; ведущая роль при этом принадлежит ИФН и АФК. Во многих случаях аутоиммунные реакции против сперматозоидов не причина, а следствие плохого качества спермы, обусловленного как генетическими, так и разными эндо- и экзогенными факторами. Патогенез развития аутоиммунных реакций против сперматозоидов связан с ОС на фоне гиперпродукции АФК, что сопровождается повреждением (фрагментацией) ДНК.
Авторы
- В.А.Божедомов - каф. акушерства, гинекологии, перинатологии и репродуктологии ФППОВ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова; каф. клинической андрологии ФПКМР РУДН, Москва
- М.А.Николаева - ФГУ Научный центр акушерства, гинекологии и перинатологии им. В.И.Кулакова
- Н.А.Липатова - каф. клинической андрологии ФПКМР РУДН, Москва
- Е.А.Спориш - каф. клинической андрологии ФПКМР РУДН, Москва
- И.М.Рохликов - каф. клинической андрологии ФПКМР РУДН, Москва
- И.В.Ушакова - ФГУ Научный центр акушерства, гинекологии и перинатологии им. В.И.Кулакова
- Н.С.Логинова - ФГУ Научный центр акушерства, гинекологии и перинатологии им. В.И.Кулакова
- Г.Т.Сухих - каф. акушерства, гинекологии, перинатологии и репродуктологии ФППОВ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова; ФГУ Научный центр акушерства, гинекологии и перинатологии им. В.И.Кулакова
Литература
- WHO manual for the standardized investigation and diagnosis of the infertile couple. - WHO, 3-th ed.: Cambridge university press, 2000.- P.32.
- Walsh T.J., Turek P.J. Immunologic infertility // Infertility in the male. Fourth edition / Ed. L.I.Lipshuitz, Howards S.S., Niederberger C.S.- Cambridge University Press, 2009. – P .277-294.
- Francavilla F., Barbonetti A. Male autoimmune infertility //Immune infertility. The impact of immune reaction on human infertility/ Ed. Krause W.K., Naz R.K– Springer, 2009.- P .145-153.
- Божедомов В.А., Лоран О.Б., Сухих Г.Т. Этиология и патогенез мужского аутоиммунного бесплодия. Часть 1 и 2 //Андрология и генитальная хирургия. – 2001.- No1.- С.72-77, 78-87.
- Krause W.K.H. Sperm function influenced by immune reaction // Immune infertility. The impact of immune reaction on human infertility / Ed. Krause W.K., Naz R.K.– Springer, 2009.- P.49-65.
- Naz RK. Antisperm contraceptive vaccines: where we are and where we are going? //Am J Reprod Immunol. - 2011.- Vol.66, N1. – P.5-12.
- Божедомов В.А., Теодорович О.В. Эпидемиология и причины аутоиммунного мужского бесплодия // Урология. – 2005. - N1. – P.35-44.
- Mazumdar M.D., Levine A.S. Antisperm antibodies: etiology, pathogenesis, diagnosis and treatment // Fertil. Steril. – 1998. – Vol.70. – P.799-810.
- Kurpisz M, Havryluk A, Nakonechnyj A, et al. Cryptorchidism and long-term consequences // Reprod Biol.- 2010. – Vol.10, N1. – P.19-35.
- Veräjänkorva E, Laato M, Pöllänen P. Analysis of 508 infertile male patients in south- western Finland in 1980-2000: hormonal status and factors predisposing to immunological infertility // Eur. J. Obstet. Gynecol. Reprod. Biol.- 2003.- Vol.111, N2. – P.173-178.
- Al-Daghistani HI, Hamad AW, Abdel-Dayem M, et al. Evaluation of Serum Testosterone, Progesterone, Seminal Antisperm Antibody, and Fructose Levels among Jordanian Males with a History of Infertility // Biochem Res Int. – 2010. – Vol.10. – P.409.
- Marconi M, Pilatz A, Wagenlehner F, et al. Are antisperm antibodies really associated with proven chronic inflammatory and infectious diseases of the male reproductive tract? // Eur Urol. - 2009. – Vol.56, N4. – P.708-715.
- 13. Hoover P, Naz RK. Do men with prostate abnormalities (prostatitis/benign prostatic hy- perplasia/prostate cancer) develop immunity to spermatozoa or seminal plasma? //Int J Androl. 2012 Aug;35(4):608-15.
- Mirilas P, Panayiotides I, Mentessidou A, et al. Effect of testis nondescent or orchidopexy on antisperm antibodies and testis histology in rats// Fertil Steril. – 2010. –Vol.94, N4. – P .1504-1509.
- Marconi M., Weidner W. Site and risk factors of antisperm antibodies production in the male population // Immune infertility. The impact of immune reaction on human infertili- ty/ Ed. Krause W.K., Naz R.K– Springer, 2009.- P.97-109.
- WHO laboratory manual for the examibation and processing of human semen. Fifth ed., WHO, 2010. - 271 p.
- Andrology: Male Reproductive Health and Disfunction. 3rd edition/Ed. E.Nieschlag, H.M.Behre, S.Nieschlag. Springer, 2010.- Р.148.
- Lee R, Goldstein M, Ullery BW, et al. Experts’ comments: Value of Serum Antisperm An- tibodies in Diagnosing Obstructive Azoospermia. M.Marconi, W.Weidner // J.Urol. - 2009.- Vol.181. –P.264–269.
- Leonhartsberger N., Gozzi C., Akkad T. et al. Organ-sparing surgery does not lead to greater antisperm antibody levels then orhidectomi // BJU Int.- 2007.- Vol.100. – P.371- 374.
- Ozturk U, Ozdemir E, Dede O, et al. Assessment of anti-sperm antibodies in couples after testicular sperm extraction. Clin Invest Med. 2011 Jun 1; 34(3):E179-83.
- Мейл Д., Бростофф Дж., Рот Д., Ройт А. Иммунология, М, 2007.- C.236, 352-363.
- Prabha V, Chaudhary N, Kaur S. Molecular mimicry between spermatozoa and bacteria. J Urol. 2011 Dec;186(6):2442-7.
- Jernias J., Witkin S.S. Molecular approaches to the diagnosis of male infertility.// Molecil. Hum. Reprod.- 1996.- V.2,No3.- P.195-202.
- Божедомов В.А., Николаева М.А. Голубева Е.Л. и соавт. Аутоиммунные реакции против сперматозоидов: эпидемиология, этиопатогенез, диагностика, лечение // Мужское здоровье и долголетие. 9-я Международная медицинская выставка, 16-17 февраля 2011, Москва // Материалы форума, 2011. - С. 20-21.
- Aitken RJ, Clarkson JS, Fishel S. Generation of reactive oxygen species, lipid peroxidation, and human sperm function // Biol Reprod.- 1989. – Vol.41. – P.183–197.
- Zorn B, Vidmar G, Meden-Vrtovec H. Seminal reactive oxygen species as predictors of fertilization, embryo quality and pregnancy rates after conventional in vitro fertilization and intracytoplasmic sperm injection // Int J Androl .- 2003.- Vol.26. – P.279–285.
- Tremellen K. Oxidative stress and male infertility—a clinical perspective // Hum. Reprod. Update. - 2008.- Vol.14, N3. – P.243-258.
- Божедомов В.А., Громенко Д.С., Ушакова И.В. и соавт. Причины оксидативного стресса сперматозоидов // Проблемы репродукции.- 2008.- N6. – C.67-73.
- Nikolaeva M.A., Kulakov V.I., Korotkova I., et al. Antisperm antibodies detection by flow cytometry is affectid by aggregation of antigen-antibody complexes on the surfase of spermatozoa// Hum Reprod.- 2000.- Vol.15. – P.2545-2553.
- Божедомов В.А., Николаева М.А., Ушакова И.В. и соавт. Роль процессов свободно-радикального окисления в патогенезе мужского иммунного бесплодия // Андроло- гия и генитальная хирургия.- 2010.- No4.- С.62-66.
- Zini A, Fahmy N, Belzile E, et al. Antisperm antibodies are not associated with pregnancy rates after IVF and ICSI: systematic review and meta-analysis. Hum Reprod. 2011 Jun;26(6):1288-95.
